近日,我校藥學院師生與上海大學、韓國高麗大學合作,在國際頂級學術期刊Angewandte Chemie(中科院一區Top,IF=16.1)發表題為"EngineeringaMultifunctionalNanozymePlatformforSynergisticMelanomaTherapy:IntegratingEnzymeActivity,ImmuneActivation,andLow-TemperaturePhotothermalEffects"的研究性論文。研究生丁啟航、劉豪威為論文的共同第一作者,上海大學陳雨教授,高麗大學JongSeungKim院士、成都大學特聘副研究員梅凌為該論文的通訊作者,成都大學為該成果的第一單位。

黑色素瘤具有生長迅速、侵襲性強等特征,導致其惡性程度極高,并具有顯著的轉移傾向。當前常用的治療手段,如化療和放療,因其嚴重的副作用及免疫抑制作用,治療效果有限。因此,開發精準且高效的綜合治療策略顯得尤為重要。在此,我們構建了一種具有多功能和多酶活性的碗狀納米系統(FeCP@PDA-GOx),實現了饑餓療法、化學動力學療法、溫和光熱療法(mPTT)與免疫療法的協同整合,旨在達成多維度的治療效果。該納米平臺利用葡萄糖氧化酶(GOx)、過氧化物酶(POD)、氧化酶(OXD)和過氧化氫酶(CAT)等多種酶的催化活性。CAT樣活性生成的O?在碗狀納米粒子開口處積聚,產生推進力,納米粒子追蹤分析(NTA)顯示FeCP@PDA-GOx在37°C的葡萄糖溶液中表現出顯著的運動性,這不僅增加了納米粒的細胞攝取,腫瘤球攝取,同時促進溶酶體逃逸作用。通過transwell模型,上層為腫瘤細胞或內皮細胞,來檢測下層腫瘤細胞的攝取,模擬從血管滲入腫瘤和腫瘤細胞間的穿透能力。并在小鼠腫瘤模型上顯示出增強的蓄積和滲透。
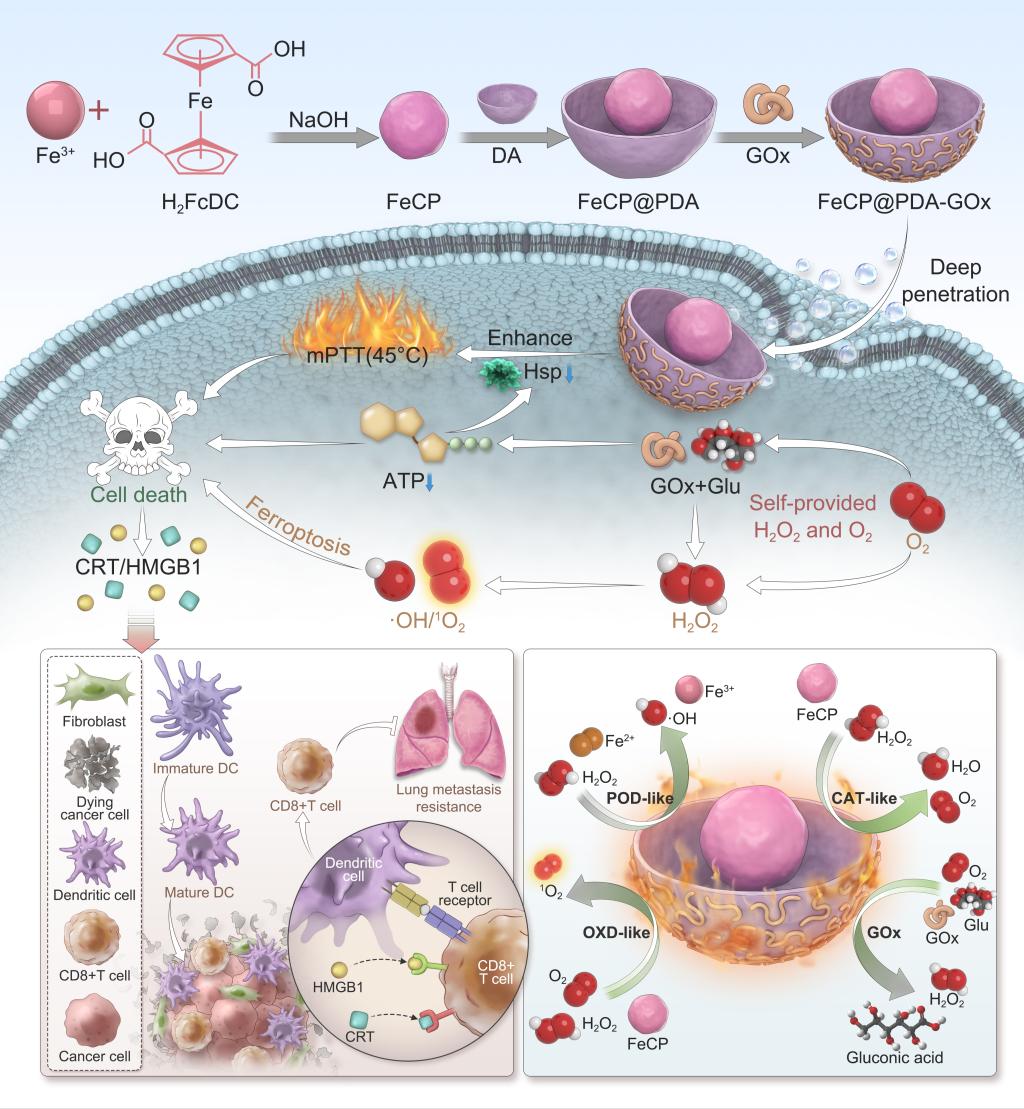
該納米平臺阻斷了腫瘤細胞的能量供應,顯著抑制腫瘤細胞中熱休克蛋白的表達,從而增強溫和光熱治療效果。此外,POD活性產生的ROS誘導了細胞的氧化應激反應,誘導了細胞中物堆積,線粒體結構嵴減少、膜收縮和外膜破裂,引起導致的細胞鐵死亡。更重要的是,該系統可激發強烈的免疫應答,有效抑制肺部轉移,并誘導系統性抗腫瘤免疫效應,從而抑制遠端腫瘤的生長。實驗結果表明,該多功能納米平臺在黑色素瘤治療中展現出卓越的療效與良好的生物安全性,為個體化醫療與智能化治療策略的進一步發展奠定了堅實基礎。
Angewandte Chemie(德國應用化學,OnlineISSN:1521-3773)是Wiley-VCH旗下著名的旗艦刊物之一,中科院1區top期刊,最新影響因子16.1。該期刊涵蓋化學綜合領域,包括但不限于有機化學、無機化學、材料化學等。特別關注化學領域的前沿研究和跨學科交叉研究,在藥劑學領域,該期刊發表的納米技術、材料科學等相關的研究成果,為藥物遞送系統的設計和優化提供了新的思路和方法。


 EN
EN 搜索
搜索


